¿Qué es el etilenglicol?
El etilenglicol es un líquido claro, incoloro e inodoro, de sabor dulce y muy higroscópico, poco volátil, por lo que ejerce una presión de vapor muy pequeña, siendo la densidad del vapor mayor que la densidad del aire.
¿Te gustaría tener un "Empleado Digital" que trabaje por ti?
Este blog funciona en piloto automático gracias a la tecnología n8n. Aprende a montar tu propio imperio automatizado por menos de lo que cuesta una pizza.
🚀 Acceder al Curso (Oferta $10)🔒 Garantía de satisfacción de Hotmart
Es el compuesto orgánico más simple de la familia de los glicoles. Su fórmula química es C2H6O2, mientras su fórmula estructural es HOCH2-CH2OH. Un glicol es un alcohol que tiene dos grupos hidroxilos (OH) unidos a dos átomos de carbono vecinos en una cadena alifática.
Es un compuesto de gran solubilidad en el agua, además de ser miscible con muchos compuestos orgánicos, como alcoholes alifáticos de cadena corta, acetona, glicerol, etc. Esto se debe a su capacidad de donar y aceptar puentes de hidrógeno de solventes próticos (que tienen H).
Polimeriza en numerosos compuestos, cuyos nombres se suelen abreviar con las siglas PEG y un número que señala su peso molecular aproximado. El PEG 400, por ejemplo, es un polímero relativamente pequeño y líquido. Mientras que los PEG grandes son sólidos blancos con aspecto grasoso.
La propiedad del etilenglicol de deprimir el punto de fusión e incrementar el punto de ebullición del agua, permite su uso como refrigerante y anticoagulante en vehículos, aviones y equipos de computación.
Propiedades del etilenglicol
- Nombres. Etano-1,2-diol (IUPAC), etilenglicol, monoetilenglicol (MEG), 1-2-dihidroxietano.
- Masa molar. 62,068 g/mol.
- Apariencia física. Líquido claro, incoloro y viscoso.
- Olor. Inodoro.
- Sabor. Dulce.
- Densidad. 1,1132 g/cm3
- Punto de fusión. -12,9 °C.
- Punto de ebullición. 197,3 °C.
- Solubilidad en agua. Miscible con el agua, compuesto muy higroscópico.
- Solubilidad en otros solventes. Miscible con alcoholes alifáticos inferiores (metanol y etanol), glicerol, ácido acético, acetona y cetonas similares, aldehídos, piridina, bases de alquitrán de hulla y soluble en éter. Prácticamente insoluble en benceno y sus homólogos, hidrocarburos clorados, éter de petróleo y aceites.
- Punto de ignición. 111 °C.
- Densidad del vapor. 2,14 en relación al aire tomado como 1.
- Presión de vapor. 0,092 mmHg a 25 °C (por extrapolación).
- Descomposición. Al calentarse a descomposición emite un humo acre e irritante.
- Temperatura de almacenamiento. 2-8 °C.
- Calor de combustión. 1.189,2 kJ/mol.
- Calor de vaporización. 50,5 kJ/mol.
- Tensión superficial. 47,99 mN/m a 25 °C.
- Índice de refracción. 1,4318 a 20 °C.
- Constante de disociación. pKa = 14,22 a 25 °C.
- pH. 6 a 7,5 (100 g/L de agua) a 20 °C.
- Coeficiente de partición octanol/agua. Log P = -1,69.
Estructura química del etilenglicol
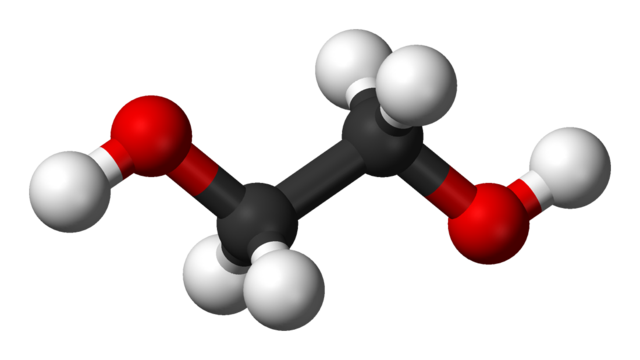
En la imagen superior tenemos la molécula de etilenglicol representada por un modelo de esferas y barras. Las esferas negras corresponden a los átomos de carbono, que conforman su esqueleto C-C, y en sus extremos están las esferas rojas y blancas para los átomos de oxígeno e hidrógeno, respectivamente.
Es una molécula simétrica, y a primera vista puede pensarse que desposee un momento dipolar permanente. Sin embargo, sus enlaces C-OH rotan, lo cual favorece al dipolo. Es además una molécula dinámica, que experimenta constantes rotaciones y vibraciones, y es capaz de formar o recibir puentes de hidrógeno gracias a sus dos grupos OH.
De hecho, son estas interacciones las responsables de que el etilenglicol tenga un punto de ebullición tan alto (197 °C).
Cuando la temperatura desciende hasta los -13 °C, las moléculas cohesionan en un cristal ortorrómbico, donde los rotámeros juegan un papel importante. Es decir, hay moléculas que tienen sus grupos O-H orientados en distintas direcciones.
Síntesis de etilenglicol
- Oxidación del etileno. El paso inicial en la síntesis del etilenglicol es la oxidación de etileno a óxido de etileno. Antiguamente, se hacía reaccionar el etileno con ácido hipocloroso para producir la clorhidrina. Luego, esta era tratada con hidróxido de calcio para producir el óxido de etileno. El método de la clorhidrina es poco rentable y se pasó a un método de oxidación directa del etileno en presencia de aire o de oxígeno, usándose el óxido de plata como catalizador.
- Hidrólisis del óxido de etileno. La hidrólisis del óxido de etileno (OE) con agua bajo presión produce una mezcla cruda. La mezcla agua-glicol es evaporada y reciclada, separándose por destilación fraccionada el monoetilenglicol del dietilenglicol y del trietilenglicol. La reacción de hidrólisis del óxido de etileno puede esquematizarse en la forma siguiente: C2H4O + H2O => OH-CH2-CH2-OH (etilenglicol o monoetilenglicol). La Mitsubishi Chemical desarrolló un proceso catalítico, mediante el uso de fósforo, en la conversión del óxido de etileno en monoetilenglicol.
- Proceso Omega. En el proceso Omega, el óxido de etileno se convierte inicialmente en carbonato de etileno, a través de su reacción con dióxido de carbono (CO2). Luego, el carbonato de etileno se somete a una hidrólisis catalítica para obtener el monoetilenglicol con un 98% de selectividad. Existe un método relativamente nuevo para la síntesis de etilenglicol. Este consiste en la carbonilación oxidativa del metanol a dimetil oxalato (DMO) y su subsiguiente hidrogenación a etilenglicol.
Usos del etilenglicol
- Refrigerante y anticongelante. La mezcla del etilenglicol con el agua permite una disminución del punto de congelación y un incremento del punto de ebullición, permitiendo que los motores de los automóviles no se congelen en invierno, ni se recalienten en verano. Cuando el porcentaje del etilenglicol en la mezcla con el agua alcanza un 70%, el punto de congelación es de -55 °C, por lo que la mezcla del etilenglicol-agua puede usarse como líquido de enfriamiento, y de protección contra el congelamiento en aquellas condiciones en que pueda producirse. Las bajas temperaturas de congelación de las soluciones de etilenglicol permite su uso como anticongelante de motores de automóviles; descongelamiento de las alas de los aviones y en el deshielo de los parabrisas. También es utilizado para preservar muestras biológicas conservadas a bajas temperaturas, evitando la formación de cristales que puedan dañar la estructura de las muestras. El elevado punto de ebullición permite que las soluciones de etilenglicol sean utilizadas para mantener temperaturas bajas en aparatos o equipos que al funcionar generan calor, como automóviles, equipos de computación, aparatos de aire acondicionado, etc.
- Deshidratación. El etilenglicol es un compuesto muy higroscópico, lo que ha permitido su uso para tratar los gases extraídos del subsuelo que poseen un alto contenido de vapores de agua. La eliminación del agua de los gases naturales favorece que sean utilizados eficientemente en sus respectivos procesos industriales.
- Manufactura de polímeros. El etilenglicol se usa para la síntesis de polímeros, como el polietilenglicol (PEG), el polietilentereftalato (PET) y el poliuretano. Los PEG son una familia de polímeros usados en aplicaciones como espesamiento de los alimentos, tratamiento del estreñimiento, cosméticos, etc. El PET se utiliza para elaborar todo tipo de envases desechables, usados en diferentes tipos de bebidas y alimentos. El poliuretano se usa como aislante térmico en refrigeradores y como relleno en diferentes tipos de muebles.
- Explosivos. Se utiliza para fabricar dinamita, permitiendo que al haber un descenso en el punto de congelación de la nitroglicerina, esta pueda almacenarse con menor riesgo.
- Protección de la madera. El etilenglicol se emplea en el tratamiento de la madera para darle protección contra su pudrición, producida por acción de los hongos. Esto es importante para la preservación de las obras de arte de los museos.
- Otras aplicaciones. El etilenglicol está presente en medios para suspender sales conductoras en condensadores electrolíticos y en estabilizadores de la espuma de soja. También se utiliza en la fabricación de plastificantes, elastómeros y ceras sintéticas. Se emplea en la separación de hidrocarburos aromáticos y parafínicos. También para fabricar detergentes para la limpieza de equipos. Aumenta la viscosidad y disminuye la volatilidad de la tinta, lo que facilita su uso. Asimismo, puede usarse en la fundición de la arena de moldeo y como lubricante durante la molienda de vidrio y cemento. También se utiliza como ingrediente en líquidos de frenado hidráulico e intermediario en la síntesis de ésteres, éteres, fibras de poliéster y resinas. Entre las resinas en las que se usa como materia prima, está el alquidal, utilizado como base de las pinturas alquidálicas, aplicadas en pinturas automotrices y arquitectónicas.
Intoxicación y riesgos del etilenglicol
- Síntomas por exposición. El etilenglicol tiene baja toxicidad aguda cuando actúa por contacto sobre la piel o si se inhala. Pero se manifiesta plenamente su toxicidad cuando es ingerido, siendo la dosis fatal 1,5 g/kg de peso corporal, o 100 mL para un adulto de 70 kg. La exposición aguda al etilenglicol produce los siguientes síntomas: por inhalación origina tos, mareo y dolor de cabeza. En la piel, por contacto, se produce resequedad. En los ojos produce enrojecimiento y dolor.
- Daños por ingestión. La ingestión de etilenglicol se manifiesta por dolor abdominal, náusea, inconsciencia y vómitos. Una ingesta excesiva de etilenglicol tiene un efecto dañino sobre el sistema nervioso central (SNC), el funcionamiento cardiovascular y sobre la morfología y la fisiología renal. Por fallas en el funcionamiento del SNC se produce parálisis o movimiento irregular ocular (nistagmo). En el sistema cardiopulmonar, se presenta hipertensión arterial, taquicardia y posible insuficiencia cardíaca. Hay alteraciones graves en el riñón, producto de la intoxicación con etilenglicol. En los túbulos renales se produce dilatación, degeneración y deposición de oxalato de calcio. Esto último se explica porque el etilenglicol es metabolizado por la enzima deshidrogenasa láctica para producir glicoaldehido. El glicoaldehido origina los ácidos glicólico, glioxílico y oxálico. El ácido oxálico precipita rápidamente con el calcio para formar oxalato de calcio, cuyos cristales insolubles se depositan en los túbulos renales produciendo alteraciones morfológicas y disfunción, lo cual puede originar insuficiencia renal. Debido a la toxicidad del etilenglicol ha sido reemplazado gradualmente, en algunas de sus aplicaciones, por el propilenglicol.
- Consecuencias ecológicas del etilenglicol. Los aviones durante su deshielo liberan cantidades importantes de etilenglicol, que terminan acumuladas en las pistas de aterrizajes, que al lavarse hace que el agua traslade el etilenglicol, a través del sistema de drenado, hacia los ríos donde su toxicidad afecta la vida de los peces. Pero no es en sí la toxicidad del etilenglicol la causa principal del daño ecológico. Durante su biodegradación aeróbica se consume una cantidad importante de oxígeno, provocando su disminución en las aguas superficiales. Por otro lado, en su biodegradación anaeróbica se pueden liberar sustancias tóxicas para los peces, como acetaldehído, etanol, acetato y metano.
Referencias
- Ethylene glycol. Recuperado de en.wikipedia.org.
- 1,2-Ethanediol. CID=174. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Cheprasov, A. Ethylene Glycol: Structure, Formula & Uses. Recuperado de study.com.
- Ethylene glycol. Recuperado de britannica.com.
- Dominic Fortes, A., Suard, E. Crystal structures of ethylene glycol and ethylene glycol monohydrate. J. Chem. Phys.
La entrada Etilenglicol se publicó primero en Lifeder.
¿Te gustaría tener un "Empleado Digital" que trabaje por ti?
Este blog funciona en piloto automático gracias a la tecnología n8n. Aprende a montar tu propio imperio automatizado por menos de lo que cuesta una pizza.
🚀 Acceder al Curso (Oferta $10)🔒 Garantía de satisfacción de Hotmart
